Chelsey L. Goins, Craig P. Chappell, Rangaiah Shashidharamurthy, Periasamy Selvaraj, Joshy Jacob; Immune Complex-Mediated Enhancement of Secondary Antibody Responses. J Immunol 1 June 2010; 184 (11): 6293–6298. https://doi.org/10.4049/jimmunol.0902530
要約
免疫記憶は脊椎動物の免疫系の特質である。初回の抗原暴露はゆっくりとした軽微な免疫反応を起こし、一方の頻回暴露では、何十年後であろうと、一次暴露より2~3倍の強度になる急速で誇張された反応を起こす。体液性免疫の場合、想起反応の有効性が高まるのは、抗原特異的抗体量の産生増幅と、その産生の加速した動態だとされている。現在の考えによると、これは長寿命の抗原特異的メモリーB細胞の選択的活性によるものと示唆されている。二次反応をメモリー細胞のみに制限する欠点は、メモリーB細胞のレパートリーが、病原体が進化を続ける一方で静的に維持されることである。本研究では、抗原特異的なナイーブB細胞が、二次反応の間にメモリー細胞と共に参加することを提案する。抗原と、一次反応由来の既成の抗体とで生体内で形成された免疫複合体が、これらナイーブB細胞を活性化し、加速した動態と増幅した大きさで反応するよう誘導することを証明する。こうして、抗原暴露の度に、継続的に新規B細胞クローンが採用されることで、免疫系は急速に変化する病原体と並び立つことが可能となる。
前書
感染予防には遅すぎる程、感染後長い時間が経過してから生じる一次抗体反応と異なり、二次反応は抗原暴露後に急速に生じる。抗体反応に関する現在の理解では、二次反応中に形成される抗体は、二次形質細胞に分化するメモリーB細胞に由来する[1,2]。これらの細胞は一次反応で活性化され、生涯に亘って宿主の中に留まり続ける。この細胞が発現する免疫グロブリンは、体細胞超変異とアイソタイプスイッチングで変化するが、依然としてその前駆細胞の抗原特異性を保持している[3,4]。仮にこれが真実であれば、特異的抗原に反応する抗体のレパートリーは静的なままであろう。一次暴露で活性化した細胞は、以降の抗体全ての供給源となるはずであり、即ち、数年後に検出される抗体は初期に記憶されたものと実質同一であるはずだ。これは宿主にとって不利であり、特に病原体は進化を続ける為である。興味深いことに、反応するB細胞の抗体のレパートリーは、経時的に且つ頻回抗原暴露により変化を遂げる[5]。三次・四次抗原暴露で反応する抗体は、一次・二次暴露で生じたものと同一ではない。これは
・ハプテン(4-ヒドロキシ-3-ニトロフェニル)アセチル(NP)
・2-フェニルオキサゾロン[6,7]
・呼吸器合胞体ウイルス[8]
・インフルエンザヘマグルチニン[9]
・リウマチ因子[10]
などの多くの系で確認されている。
最近、我々の研究室では、二次抗体反応の大部分が非胚中心由来のB細胞だと証明した[11]。これらの細胞は抗原特異的であり、発現している可変領域は体細胞超変異が起こっていなかった。B細胞記憶の微小な構成要素が胚中心外(extra germinal center)B細胞に由来する[12]ものの、これらの細胞は観察された集団を説明するに十分な数ではない。この集団の考えうる一つの可能性として、これら非胚中心由来細胞の幾つか、或は全てが、二次抗原暴露の場合に限り活性化するナイーブB細胞ということだ。その通りであれば(=二次抗体反応の大部分がナイーブ細胞)、その後の抗原暴露ごとに抗体のレパートリーが変化する方法と理由が説明可能であろう。
一次反応では、ナイーブB細胞が分化し、抗原暴露から数日後に抗体産生が生じる。対してその後の二次抗原暴露では、B細胞はタイムラグを短縮して拡大し、より大量の抗体を産生する。一次暴露と二次暴露で異なる点は、メモリーB細胞と、(※一次暴露で生じた)既成の抗原特異的抗体の存在である。これらの抗体は抗原と免疫複合体を形成し、また既知の通り、免疫複合体は、抗原単独の場合よりも高い力価の抗体産生を誘導する[13]。免疫複合体介在性の増強反応で想定される機構には、補体カスケードの活性化がある。免疫複合体は、特にアイソタイプIgG2aやIgG3抗体を含有する場合、補体古典経路を活性化できる[14]。補体受容体のCD21はB細胞コアセプター複合体の一部である為、B細胞の活性を増強することになる。加えて、免疫複合体は様々な細胞型と結合可能であり、特に樹状細胞とはFcγRと通じて結合する。樹状細胞では、FcγRとの結合が細胞活性を促し、このことで抗原提示の増強、共刺激分子の発現増加が生じる[15]。これらの効果により、更なる効率的なB細胞、T細胞の活性化が生じる。
本研究では、二次反応の特徴である短縮したタイムラグと増大した抗体産生が、免疫複合体介在性のナイーブ細胞及び抗原特異的メモリーB細胞の増強によるものであることを提案する。我々は、免疫複合体が加速した動態でナイーブB細胞を活性化可能であり、また、ナイーブB細胞は二次反応の初期段階で活性化し、この活性化は活性化したFcγRの関与に依存することを証明する。
素材と方法
-マウスと免疫化
動物はAmerican Association of Laboratory Animal Careの認定を受けた施設で、エモリー大学ワクチン研究センターの特定の病原体を含まない条件下で飼育された。FcRγ-/-マウスをタコニック農場(ニューヨーク州オールバニ)から、C3-/-マウスをジャクソン研究室(メイン州バー・ハーバー)から購入した。他全ての研究C57BL/6マウス(チャールズ・リバー研究室:マサチューセッツ州ウィルミントン)で実施した。鶏γグロブリン(CGG)(バイオサーチテクノロジー:カリフォルニア州ナバート)と結合したハプテンNP(NPCG)をこれらの研究に使用した。一次免疫反応は、50μgのミョウバン沈殿NPCG、CGG或はオボアルブミン(OVA)を250ngの百日咳毒素(リスト生物学研究室:カリフォルニア州キャンプベル)と共に腹腔内注射で誘発した。二次反応は20μgの溶性NPCGを尾静脈注射により誘発した。免疫化に免疫複合体を使用した実験では、これら複合体を25μgのNPCGと50μgのNP特異的mAb(pEVCHγ1)を37℃で2時間培養することによりin vitroで作製し、腹腔内投与した[16]。ヒトCD32a抗体は、マウスのIgGサブタイプと結合可能である。補体の枯渇の為、[17]に記載の通り、マウスは、二次免疫化の28時間前、24時間前、及び4時間前に5μgのコブラ毒因子(シグマ-アルドリッヒ:ミズーリ州セントルイス)を腹腔内注射した。Emory University Institutional Animal Care and Use Committeeは全ての研究を承認した。
-養子免疫細胞移入
TcRトランスジェニックOT-IIマウス(C57BL6バックグラウンド)の単細胞脾臓懸濁液をRBC溶解し、洗浄後、PBSに再懸濁した。精製TCRβ5.1/5.2+CD4 T細胞(1-2×106)を、免疫化の1日前にLy5.1コンジェニックマウスに尾静脈から投与した。
-ELISA法
血清NPまたはCGG Ab力価は、ELISAアッセイを改変して測定した。96ウェルマイクロプレートを、PBS中の20μg/ml NP-BSA(Biosource Technologies、Navato、CA)または20μg/ml CGG(Sigma-Aldrich)の溶液で4℃にて一晩コートした。4%の脱脂乾燥乳(Bio-Rad、Hercules、CA)を含むPBSの溶液を用いて、プレートを37℃で1時間ブロッキングした。IgGまたはIgMアイソタイプに特異的なHRP結合抗マウス抗体(Southern Biotech, Birmingham, AL)を塗布し、室温で1.5時間インキュベートした後、血清試料を塗布し、反応させた。プレートをテトラメチルベンジジン基質で現像し、450nmの吸光度を読み取った。値をIgGまたはIgMの既知の希釈液と比較し、Ab濃度を算出した。補体成分C3のELISAは、マウスC3 ELISAキット(Immunology Consultants Laboratory, Newberg, OR)を用いて指示通りに実施した。
-ELISPOTアッセイ
ELISPOTアッセイは、96ウェルニトロセルロースプレート(Millipore、Billerica、MA)を100μl PBS中の20μg/ml NP-BSAで一晩コーティングしたことを除いて、記載[18]通りに実施した。スポットは、ELISPOTリーダー(Cellulara Technologies, Cleveland, OH)を用いて可視化し、手動でカウントした。
-統計
特に指示のない限り、すべての統計値を生成するために、対にならない両側スチューデントtテストを使用した。統計的な指定については*p < 0.05; **p < 0.01; ***p < 0.001.
結果
-免疫複合体はナイーブな動物の免疫反応を増強する
先行研究では、免疫複合体、或は免疫前に受動投与された特異的抗体で免疫した後、免疫反応が増強することが確認されている[19,20]。これらの結果を再検討するべく、NPCGとモノクローナル抗NP抗体の免疫複合体でナイーブマウスを免疫化した。免疫化から4日後、血清中の抗CGG抗体値(図1A)と、NP特異的抗体を分泌する脾臓細胞をELISPOT(図1B)で検討した。

1.in vitroで生成したNPCG-抗NP抗体の免疫複合体(IC)、
2.ミョウバン沈殿NPCG(Alum)
のいずれかで免疫化した。
免疫化から4日後、血清と脾臓をELISAとELISPOTアッセイでそれぞれ収集した。
A:2群の血清抗CGG抗体価。エラーバーは平均±標準誤差を表す。
B:106個の脾臓細胞当たり、NP特異的抗体を分泌する形質細胞の数をプロットした。エラーバーは平均±標準誤差を表す。
データは2回の独立した実験(n = 5~6)から得られた代表的な結果である。
**p < 0.01; ***p < 0.001。
免疫複合体(IC)投与マウスは抗CGG抗体価が5416±1484ng/mlを示し、これはミョウバン沈殿NPCG(Alum)投与マウス(226±52ng/ml)より有意に高かった。同様に、免疫複合体免疫化ナイーブマウスは、NP特異的抗体形成細胞の数が、Alum群より有意(p=0.0006)に多かった。これらのデータより、免疫複合体は、抗原単独暴露の場合よりも急速且つ効率的な免疫反応を惹起する形で、抗原に未暴露細胞を刺激するものと結論付けた。
-免疫複合体は、補体活性ではなく、FcγRとの結合を介して二次反応を刺激する
免疫複合体の強力な刺激能を確認した所で、次に考慮すべき件は、免疫複合体が二次抗体反応の生成にどの程度関与しているかを決定することだと思われる。免疫複合体は二次免疫後に生体内で自然に形成されるためである。二次反応における免疫複合体の役割を決定すべく、免疫複合体に使用される二つの主要活性経路-FcγR結合/補体活性-を対象とした。
免疫複合体は、FcγRと結合することで、様々な細胞型に強力な刺激影響を発揮する。この作用が二次抗体反応の生成に役割を果たしているか決定するべく、抗CD32抗体でFcγRと免疫複合体の結合を阻害した。抗CD32抗体は組み換え型溶性FcγR二量体であり、細胞表面のFcγRよりも高いアヴィディティで免疫複合体のFc領域と結合する[21,22]。B6マウスのコホートに50μgのミョウバン沈殿NPCGを腹腔内注射で免疫化し、メモリー期(30日目以上)まで発育させた後、20μgNPCGを静脈注射で二次免疫する2日前に抗CD32抗体を投与した。免疫から4日後、脾臓細胞を採取し、ELISPOTアッセイでNP特異的形質細胞の定量を行った。免疫前に抗CD32抗体を投与されたマウスは、抗CD32未処理の二次NPCG免疫を受けたマウスに比較し、IgG(p=0.035)とIgM(p=0.034)のB細胞反応が有意に減少していた(図2A)。
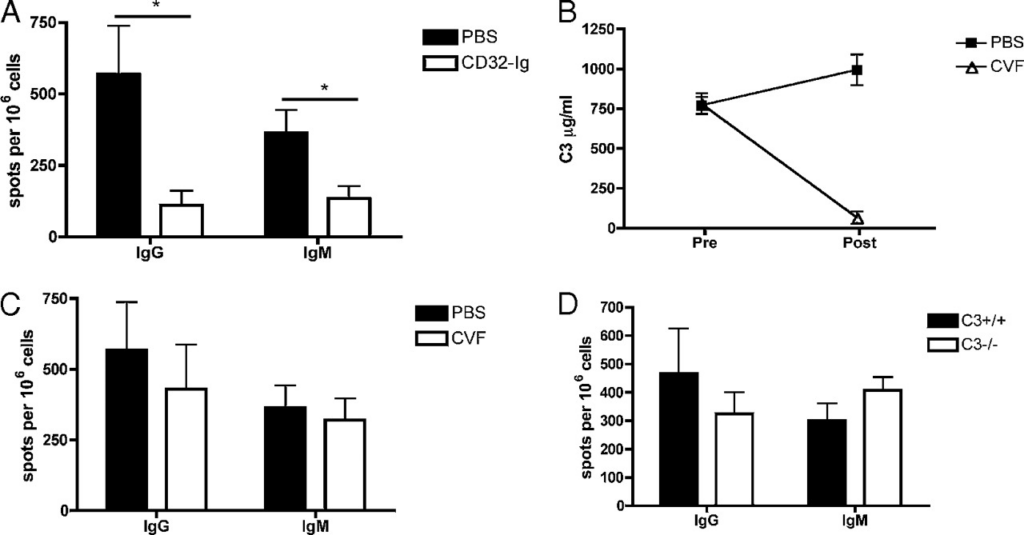
A:C57BL/6マウスを50μgNPCG/alumで免疫化し、30日後に再度20μgNPCGを静脈注射で免疫した。マウスは二次免疫の2日前に生理食塩水(PBS)か20μgの抗CD32抗体の何れかを投与された。二次免疫から4日後、脾臓細胞を採取し、ELISPOTによりex vivoで検討した。106個の脾臓細胞当たりNP特異的抗体産生細胞の数を、X軸に抗体のアイソタイプにしつつプロットした。
B:NPCG免疫C57B/6マウスを20μgのNPCGで静脈注射で免疫した。免疫の28時間前、24時間前及び4時間前にPBSか5μgのコブラ毒因子(CVF)のどちらかをマウスに注射した。CVF処理前と処理から1日後の血清を収集し、ELISAでC3の値を分析した。C3は両時点でのμg/mlでプロットした。二元配置分散分析によるp<0.0001。
C:免疫から4日後、脾臓細胞を採取し、NP特異的形質細胞をELISPOTによりex vivoで計量した。106個の脾臓細胞当たりのNP特異的抗体分泌細胞を、X軸を抗体アイソタイプにしつつプロットした。データは3つの独立した実験(n=5~8)の代表的な結果を示している。
D:C3-/-マウスと統制野生型マウスに、まず50μgのNPCG/alumで免疫化し、30日後に20μgのNPCGを静脈注射した。4日後、ELISPOTでNP特異的形質細胞を計量した。106個の脾臓細胞当たりのNP特異的IgG抗体及びIgM抗体分泌細胞の数を、X軸を抗体アイソタイプにしつつプロットした。データは2つの独立した実験(実験当たりn=4)結果の代表を示している。
全ての実験でエラーバーは平均±標準誤差を表す。*p<0.05
そうして、生体内で免疫複合体のFcγRとの結合を阻害すると、二次免疫反応が強く消失し、免疫複合体がFcγRとの相互作用を介して二次抗体反応の発生に必要な役割を果たすことが示唆された。
次に、コブラ毒因子(CVF)で補体を枯渇させることで、二次抗体反応中の補体経路の役割を検討した。CVFはC3b相同体であり、補体カスケードの無制御な活性を誘発し、補体タンパク質を全て一時的に枯渇させる[23]。NPCG免疫C57B/6マウスに、20μgのNPCGを静脈注射による二次免疫をする前に、5μgのCVFを3度注射した。CVF処理前と1日後のマウスから採血し、C3のELISA法で補体枯渇のレベルを検討した。CVF処理を受けたマウスは、CVF投与前の値とCVF未投与マウスの値と比較して、補体タンパク質C3のレベルが有意に減少(1桁低い;p>0.0001)しており、補体の枯渇が確認された(図2B)。二次免疫から4日後、脾臓細胞を採取し、NP特異的抗体分泌細胞をELISPOTで検討した(図2C)。二次免疫前にCVFを投与されたマウスは、IgG(p=0.59)とIgM(p=0.70)産生細胞両方が統計的には有意でない減少が見られた。
CVF処理でC3レベルは減少したが、完全に除去されることはなかった(図2B)。C3が完全に存在しない環境下でこれらの結果を確認するべく、C3欠損マウス(C3−/−)の二次反応を検討した。C3−/−マウスと統制野生型マウスに50μgのNPCG/alumを免疫化し、30日以上後に20μgNPCGを静脈注射して二次チャレンジを実施した。4日後、脾臓細胞を採取してELISPOTでNP特異的抗体分泌細胞を確認した(図2D)。C3−/−マウスに二次抗体反応の欠損は見られなかった。野生型マウスと同等レベルのIgG(p=0.48)とIgM(p=0.208)抗原特異的形質細胞反応を示し、CVFによるC3枯渇による我々の先行結果を確認できた。これらのデータは、二次抗体反応において補体の役割が最小限であることを示唆する。
-活性したFcγRのシグナル鎖欠損マウスは、二次抗体反応を消失させる
FcγRsはIgGと多くの形態で結合し、その中には免疫複合体も含まれる。一度IgGがこれらの受容体と結合すると、接触したシグナル鎖を介して細胞に信号が送信される。FcγRの中には、IgG免疫複合体が結合した時に細胞を活性化させるものがある。これら受容体はγシグナル鎖(FcRγ)を持ち、主に抗原提示細胞に見られる[24]。二次抗体反応が活性化したFcγRを介したシグナルの産物であるか決定するべく、FcRγ−/−欠損マウスでの二次反応を検討した。予想通りであれば、これらマウスは二次反応に失敗するはずである。FcRγ−/−コホートマウスと野生型のFcRγ+/+に50μgのNPCG/alumを免疫し、(30日以上の)免疫を獲得させた。マウスから採血を行い、ELISAにより血清中の抗体を計量して、γ鎖欠損動物が一次反応を形成しうるか検討した。FcRγ−/−マウスはFcRγ+/+と類似のIgG反応(p=0.10)を示すことが判明した(図3A)。次に、これらのマウスを20μgの溶性NPCGで免疫した。4日後、マウスを屠殺し、ELISPOTでNP特異的抗体分泌脾臓細胞を計測して二次B細胞反応を検討した(図3B)。予想通り、FcRγ−/−マウスは、統制野生型のFcRγ+/+マウスに比べて、二次B細胞反応を有意に消失(p=0.01)させており、頻回抗原暴露に対する反応において、抗原特異的IgG分泌細胞の産生が少なかった。
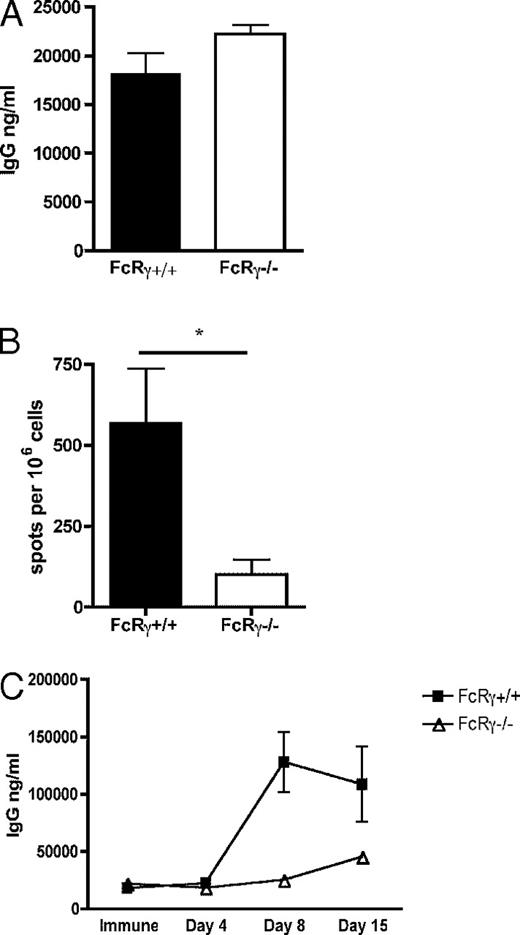
A:FcRγ−/−マウスを50μgのNPCG/alumで免疫した。免疫から30日後、血清を採血してELISAで抗体レベルを分析した。同じ処理をした 統制野生型FcRγ+/+マウスと結果を比較した。NP特異的IgGのレベルをng/mlでプロットした。
B:NPCG免疫マウスに20μgNPCGを静脈注射により二次免疫した。免疫から4日後、脾臓細胞を採取し、ELISPOTでex vivoで計量した。106個の脾臓細胞当たりのNP特異的IgG分泌細胞の数をプロットした。
C:二次免疫の前後の様々な間隔で血清を採取し、ELISAでNP特異的抗体レベルを分析した。NP特異的IgGレベルをng/mlでプロットし、X軸には二次免疫との相対時間を示した。全ての実験において、エラーバーは平均±標準誤差を表す。データは2つの独立した実験(n=4~6)の代表値である。*p < 0.05.
FcRγ−/− マウスの二次反応の動態を更に掘り下げるべく、二次免疫後の様々な時期で血清を採取し、ELISAで抗原特異的IgG抗体を測定した(図3C)。統制側のFcRγ+/+野生型マウスは通常のIgG二次反応を形成し、二次免疫から8日後に急速な抗体量の増加のピークを迎えた。しかし、FcRγ−/−マウスにおけるIgG反応の形成は大きく遅れが見られ、抗体は二次免疫から15日後まで出現せず、緩やかな増加が観測された。全体的に、FcRγ−/−マウスは有意にIgG力価が低かった。これらのデータは、FcRγ鎖を介した信号が、免疫複合体との結合を起点としており、急速で増強した二次抗体反応にとって決定的であることを示している。
-免疫複合体はナイーブCD4T細胞活性を刺激する
免疫複合体がB細胞反応を増強する一つの可能性は、抗原提示細胞を介したCD4 T細胞へのpMHCII提示の増加を通じて、CD4 T細胞の助けを増強することである。免疫複合体がナイーブCD4 T細胞の急速な活性化と拡大をもたらすかどうかを決定するために、CFSE標識したLy5.2+ OVA特異的TCRトランスジェニックOT-II CD4 T細胞を先天性Ly5.1 C57BL/6マウスに移植した。次に、これらのレシピエントに免疫複合体化OVA、OVA単独、またはPBSを静脈注射で免疫した。4日後、レシピエントマウスを屠殺し、ドナーのLy5.2+ CD4 T細胞の活性化と増殖を調べた(図4A)。CD44のアップレギュレーションで測定される活性化は、免疫複合体免疫群で最も高かった。同様に、CFSEの希釈によって測定された細胞分裂は、OVAまたはPBS対照と比較して、免疫複合体を投与されたマウスで最も高かった。驚くことではないが、免疫複合体免疫マウスから得られたOVA特異的CD4 T細胞の全体数は、統制群から得られたもの(p = 0.01)よりも有意に多かった(図4B)。これらのデータは、免疫複合体がin vivoでナイーブな抗原特異的CD4 T細胞の活性化と増殖を促進することを示唆している。
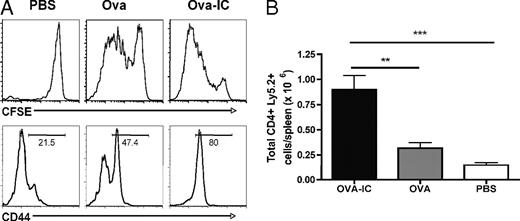
A:CFSE希釈による細胞分裂と活性化マーカーCD44の発現を示す。列は異なる抗原処理を示す。
B:脾臓あたりのドナーCD4+ Ly5.2+ T細胞の総数をプロットした。エラーバーは平均±標準誤差を示す。示されたデータは、2つの独立した実験(n = 3~5)からの代表的な結果である。**p < 0.01; ***p < 0.001。
-ナイーブB細胞が二次抗体反応に参加する
以前の報告で、我々はナイーブB細胞が二次抗体反応において主要な役割を果たしていることを示した[11]。免疫複合体がナイーブB細胞と二次抗体反応の両方に対して強力な活性化作用を持つことを示したので、我々は免疫複合体が二次反応の間にナイーブ細胞の参加をどの程度刺激するかを調べたいと考えた。二次反応の環境下でナイーブ細胞が反応する能力を証明するために、マウスをCGGで免疫し、免疫を形成させた後、NPCGで免疫した。二次免疫前、これらのマウスはCGG特異的メモリーB細胞と抗CGG抗体を産生する形質細胞を有していたが、NPに対しては完全にナイーブであった(図5A)。しかし、NPCGによる免疫後、マウスは迅速な抗NP反応を示し、免疫後4日のELISPOTで検出されたように、多数のNP特異的抗体分泌細胞が反応した。その結果、より多くの細胞がより迅速に反応し、一次反応よりも二次的なNP反応に類似していた(図5B)。この増強が既存の抗体の抗原特異性に依存していることを示すため、OVA免疫マウスにNPCGを免疫した。予想通り、このコホートでは通常の一次免疫よりもNP特異的B細胞は生成されなかった。この所見は、CGG特異的抗体で生成された免疫複合体の存在が、二次反応におけるナイーブB細胞の採用に必須であることを示している。通常の二次反応とは異なり、反応したNP特異的細胞の多くはIgGではなくIgMを発現した。すべてのNP特異的細胞はナイーブで、まだ胚中心反応を経ていないはずだから、これは当然である。このNP特異的ナイーブB細胞の活性化には免疫複合体が必要であることを確認するため、抗CD32抗体でFcγRの結合を阻害した。予想通り、FcγRの結合を阻害すると、ナイーブNP特異的B細胞の反応への参加が阻止された(図5B)。その結果、ナイーブB細胞は免疫複合体を介した活性化によって、二次反応に誘い込まれる可能性があると結論づけられた。

A:ナイーブC57B/6マウスに50μgのミョウバン中CGGを免疫した。免疫30日後に血清を採取し、ELISAで抗体レベルを分析した。IgGレベルをng/mlでプロットし、抗体特異性、CGGまたはNPをX軸に示した。
B:CGG免疫マウスを20μgのNPCGで静脈注射で免疫した。免疫の4日後、脾臓細胞を採取し、ELISPOTにより生体外で調べた(CGG/NPCG;黒棒)。脾臓細胞106個当たりのNP特異的抗体分泌細胞数をプロットし、抗体アイソタイプをx軸に示した。データは、ミョウバン中50μgのNPCGで免疫した4日後の一次反応(NPCG一次;ストライプバー)、ミョウバン中50μgのOVAで一次免疫したマウスにおけるNPCGに対する二次反応(OVA/NPCG;白バー)、および二次免疫の2日前に20μgのCD32-Igを投与したCGG免疫マウスにおけるNPCGに対する二次反応(CGG/NPCG + 抗CD32抗体;グレーバー)と比較した。IgGとIgMの両方について、一元配置分散分析によるp<0.0001。すべての実験について、エラーバーは平均±標準誤差を示す。データは3回の独立した実験(n = 3~7)の代表値である。
-メモリーCD4T細胞単独では、ナイーブ細胞活性を介した抗体反応の増強には十分でない
上記の実験(図5B)において、CGG免疫マウスはNPCGで免疫するとNPに対する一次反応が増強されることが示された。この増強はCGG特異的抗体の存在によるものと考えられる。しかし、CGGでプライミングされたT細胞もまた存在し、新しく活性化されたB細胞を助けることができる。抗体反応に対するCGGでプライミングされたT細胞単独の効果を観察するため、CGG免疫B6マウスから5×106 CD4+T細胞を単離し、個々のナイーブB6マウスに養子移入した。移植の1日後、これらのマウスに20μgのNPCGを静脈注射で免疫した。免疫の4日後、NP特異的抗体産生細胞について脾細胞をELISPOTで調べた(図6)。免疫前にナイーブT細胞を投与されたマウスと比較して、CGGでプライミングされたT細胞を投与されたマウスではIgM応答の増加は見られなかった(p = 0.8101)。興味深いことに、IgG応答は有意に増加した(p = 0.0338)。これはメモリーCD4 T細胞の存在下でクラススイッチングが促進されたためと考えられる。これらのデータから、プライムCD4+ T細胞の存在は抗体反応を適度に増強するが、それだけでは二次的な抗体反応を誘導するには不十分であると結論した。

考察
本研究では、二次抗体反応に関する長らく甘受されてきたモデルに欠けていた重要な要素…ナイーブB細胞の関与…の証拠を提示する。これらの細胞は、二次抗原暴露で形成される免疫複合体により活性化し、急速で頑健な抗体産生を惹起する。この活性は免疫複合体のFcγRとの結合能に依存しており、補体の役割は最小限であるように思われる。また、FcRのγシグナル鎖欠損マウスは、一次反応には成功するものの、免疫に対する二次反応を起こせないことも証明された。
免疫複合体の強力な体液性免疫反応を誘導する能力は長く知られていた。一連の初期の実験[13,25-27]では、これら分子の活性化能力が証明され、抗体産生産生、胚中心形成を増強し、増大した運動で記憶形成を刺激することが可能だと判明した。更に、受動投与された抗体が免疫複合体と同様の効果…抗体産生と細胞活性の増強…をもたらすことも明らかとなった[28]。我々の結果はこれらの報告を確認し、免疫複合体の機能として二次抗体反応の刺激が加わる形で拡張するものである。
免疫複合体は増大した動態でナイーブ細胞を活性化させられること、二次的な抗原暴露後に免疫複合体が存在することから、免疫複合体はナイーブ細胞を活性化し、二次反応に参加する可能性が高い。我々の研究室や他の先行研究により、二次抗体反応は、完全な記憶に基づく現象ではないことが示唆された。胚中心由来B細胞を永続的にYFPでマークしたマウスモデルにより、マークのないナイーブB細胞が二次抗体反応のほぼ2/3量を説明することを発見した[11]。また、養子免疫細胞移入による実験で、ナイーブB細胞が想起反応中に採用されることも証明された[29,30]。この研究では、ナイーブ細胞が二次反応に参加可能であり、一次抗原暴露後に血清中に生成される抗原特異的抗体がこの参加に必要であることが証明された。我々の実験では、CGG免疫マウスは、CGGへの二次反応の刺激に細胞性・体液性環境を必要としたが、これらマウスはメモリーB細胞とNP特異的抗体に欠けていた。しかし、CGGと結合したNPの二次免疫すると、これらマウスは強固なNP特異的反応を発生させる。これらマウスはNPへの事前の免疫はないため、反応する全ての細胞はナイーブでなければならず、全てのNP特異的抗体はナイーブ細胞由来でなければならない。換言すれば、二次反応の環境では、ナイーブB細胞が活性化され、メモリー細胞と同程度に素早く大量に反応する。
ナイーブB細胞活性化の現在の理解では、二次反応の急速さを説明できない。しかし、膜結合免疫複合体による活性化でB細胞受容体がインテグリンとコアセプターのシナプスに組み込まれ、これによりB細胞活性に必要なシグナルの閾値が低下し、より急速な抗体反応を起こすことになる[31]。FcγRか補体の何れかが、これら免疫複合体を細胞表面に固定し、補体もCD21を介してB細胞を共刺激する可能性があるが、我々の結果は、二次抗体反応において免疫複合体に機能を付与しているのは、補体よりもFcγRであることを示唆している。この知見は、免疫複合体の刺激効果がFcγRの活性に依存的[32]で、補体を必要としない[33]と明らかにした研究により支持される。加えて、FcγRと結合した免疫複合体は、細胞表面にそのままの形で残り、その状態でB細胞に提示されることが示されている[34]。ナイーブ細胞の活性化がない場合であっても、メモリー細胞や長寿命の形質細胞が抗原チャレンジに反応するよう存在していることから、二次反応が完全にFcγR依存性であることは興味深い。これは、メモリーB細胞の活性もまた免疫複合体との相互作用に依存的であるか、或は以前から示唆されている通り[35]、メモリー細胞は防御免疫の主要な要素ではないことを示唆している。
FcγRは多くの細胞型に存在するが、我々の結果は、二次反応における免疫複合体の増強には、γシグナル鎖を使うFcγRが必要であることが示唆される。これらの活性化したFcγRがB細胞には存在しない[24]ことから、B細胞の活性には中間的な細胞が関与しているはずである。最も可能性が高いのは抗原提示細胞だが、抗原提示細胞は必要なFcγRと、T細胞活性能を有する為である。このプロセスに関与する抗原提示細胞の同定には更なる研究が必要である。
体液性免疫における現在のパラダイムは、頻回抗原暴露に対する頑健な抗体反応に示される通り、免疫記憶が防御免疫を担うというものである。しかし、我々は、二次反応にはナイーブB細胞も活発に参加すること、その採用はFcγRの活性と、一次抗原暴露中に生成された既成の血清抗体に依存的であることを示した。これらのデータは、一次免疫反応と二次免疫反応との間で作用し、抗原特異的血清抗体を介する、これまで評価されてこなかった正のポジティブフィードバック機構を明らかにする。このメカニズムは、CD4T細胞の急速な活性化を介した二次抗体反応の加速し、新規B細胞クローンの採用によって抗体レパートリーを多様化する。そうして、免疫系は高親和性メモリーB細胞反応を保持しつつ、積極的に新規B細胞クローンを採用することで、抗体反応を継続的に多様化しつつ、また、抗原暴露ごとに高親和性抗体が確実に産生されるようにしている。このプロセスにより、免疫系は急速な病原体の進化に追い付くことが可能となる。
