前書
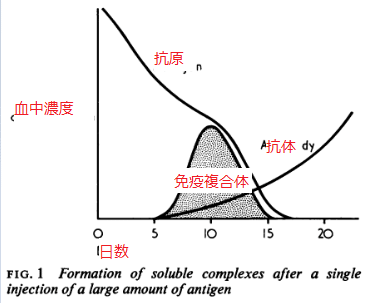
過去数十年に亘り、免疫複合体の沈着が人間の広範な疾患の主徴だと明らかになってきた。疾患プロセスを議論する前に、免疫複合体そのものと、その組成、形状、組織への沈着を支配する因子をまず考察する必要がある。馬血清等、大量の単回抗原注射で形成される可溶性複合体を図1に示す。
複合体の組成
疾患を惹起する複合体の分子量は通常500,000を超え、免疫グロブリンと、複合体の形成を刺激する抗原で構成される。
抗原は、
・関節リウマチのような変性した免疫グロブリン
(Whaley and CarsonDick,1969)から
・ウイルスまで
(Gyorkey, Min, Sincovics, and Gyorkey,1969;Dixon, Oldstone, and Tonietti,1970;Onion, Crumpacker, and Gilliland,1971)
様々で、
ウイルス-抗体複合体は、循環系と組織損傷部位の両方に検出される (Oldstone andDixon, 1971)。
免疫グロブリンのみで構成される複合体は”混合型”(Cream, 1972)であり、
・IgM ⇨ IgG(一般的なリウマチ因子)
・IgG1 ⇨ IgG3
・IgG3 ⇨ IgG1
・IgA ⇨ IgG ⇦ IgM
・IgG ⇨ IgA
などが考えられる。
※上記の免疫グロブリンはその産生が刺激されたものであり、矢印は誘導される方向を示す。
この免疫グロブリン複合体は4℃に達すると沈殿することがあるが、これは骨髄腫やワルデンシュトレームのマクログロブリン血症のモノクローナルクリオグロブリンと、クリオフィブリノーゲン血症や寒冷凝集素病で生じる寒冷凝集体とは区別される。
複合体形成
急性血清病は、抗原過剰域で形成される比較的小さな複合体の沈着で生じる全身性疾患である。
・単回抗原投与後に生じる過敏症であり、
・投与後7~14日後に発症する。
しかし、急性及び慢性血清病は、共に反復抗原投与後に惹起し、
その複合体は、
・循環中の抗原が新規に形成された抗体と結合しつつ短期間で形成されるか、
・長期間に亘って低濃度かつ持続的に形成される。
(Dixon,Vasquez,Weigle,and Cochrane,1958; Germuth,Senterfit,and Pollack,1967b)。
アルザス反応は、可溶性抗原に感作した動物への注射後、数時間以内に生じる限局性紅斑と浮腫であり、抗体過剰域で巨大な免疫複合体の形成により生じる。
血清病とアルザス反応は臨床的には全く異なるが、免疫複合体疾患のスペクトラムの一部とするのが恐らく正しく、
複合体の
・サイズ
・組成
・沈着部位
で区別される。
これらの要因は経時的に変化し、血清病とアルザス反応双方の特徴は、単一の疾患プロセスの異なる段階で観測される可能性がある。
複合体の溶解性
如何なる複合体でも、その溶解性は複合体の組成で変化する。以下の図はオボアルブミン※と抗オボアルブミンの沈殿曲線である(図2)。
※卵白中の主要タンパク質
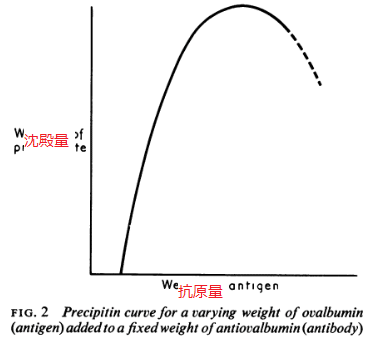
抗原過剰域の複合体は、抗体過剰域の場合に比較して溶解性を示し、抗体過剰複合体が急速に沈殿し、投与部位付近に留まる傾向にある一方、抗原過剰の可溶性複合体は全身性疾患に繋がる可能性がある。
In vitro研究により、循環中で
・可溶性複合体
・遊離抗原
・不溶性複合体
・微量の遊離抗体が
平衡状態で存在することが示唆されている(Germuth,Keleman,and Pollack,1967a)。
この平衡状態は複合体の全体公式で表現される。
Ag2Ab ⇔ Ag3Ab2 ⇔ AgAb ⇔ AgAb2 ⇔ AgAb3
※Ag:Antigen:抗原/Ab:Antibody:抗体
→”Ag2Ab”は抗原:抗体=2:1を示す
これは以下に単純化される。
可溶性複合体 ⇔ 不溶性複合体
免疫複合体疾患は、特に抗原投与に対して低親和性抗体が産生された場合に生じることが示唆されている(Soothill and Steward, 1971)。この結果、まず
・抗原の不完全な免疫除去に始まり、
続いて産生される可能性のある高親和性抗体が少量である為、
・抗原過剰の状態が続き、高い溶性を示す複合体が形成される可能性が高いということである。
複合体の沈着
相対的に不溶性の複合体は、通常は網内皮系の貪食細胞によって急速に除去される。しかし、免疫複合体疾患では、複合体が幾つかの組織に沈着し、そこで血中の貪食細胞を免れて数週間残存する。
関節の滑膜の他にも、複合体の沈着する主要部位は、血管壁、特に腎臓と皮膚である。
血管壁を通過して拡散する間に、遊離抗原が血管壁をより急速に移動する為に、可溶性複合体がより溶解度の低い複合体に再平衡化される可能性がある。
腎糸球体では基底膜の上皮側に、皮膚静脈では皮膚乳頭の毛細血管ループ、特に基底膜の周辺に、動脈では弾性板に複合体が沈着することがある。
複合体沈着に影響を与える要因は数多くあり、関与する臓器にも、臓器と複合体の沈着部位にも影響を与える。
1) 静水圧
2) 血管透過性
3) 複合体の濃度
4) 複合体の組成
5) 時間
1) 静水圧
腎臓や皮膚への複合体沈着において静水圧の差異は最も重要である。腎臓の場合、腎動脈狭窄や水腎症でその差異が消失すると、影響を受けた腎臓は免疫複合体沈着から保護される(Germuth andothers, 1967a)。
急性糸球体腎炎は、主として髄質周辺に位置する糸球体(結果として主要な血液供給源にも近い)で発生するが、これは、皮質外部に位置し、主要な血液供給源から離れている糸球体と比較して、糸球体内部の静水圧が高い為であろう(Germuthandother,1967a)。
2) 血管透過性
血管透過性の増加により血管壁に複合体が沈着しやすくなり、血管作用性アミンの局所的放出が複合体沈着におけるメカニズムとして示唆されている。
3) 複合体の濃度
低濃度の可溶性複合体が長期間残存すると糸球体腎炎を惹起し、動脈病変の発症には高濃度の複合体を必要とする(Germuth and others, 1967a)。
4) 複合体の組成
これは恐らく、複合体の組織内での正確な沈着部位に影響する主要因の一つである。Ag:Ab=2:1のような溶解性の高い複合体は、3:1のような複合体より血管壁内により深く浸透することが予想される。実際、アルザス反応は主に静脈内皮の損傷と関連しており、動脈弾性板のフィブリノイド壊死は血清病と関連している。
5) 時間
複合体の組成は経時的に変化するが、動脈病変の分布も抗原刺激の期間中に変化する(Heptinstall and Germuth,1957)。冠状動脈、肺動脈病変が急性及び慢性血清病で生じる一方、腎血管系は急性血清病ではほとんど影響を受けず、弓状動脈と葉間動脈の病変が慢性血清病で惹起する。
関節内の複合体沈着に影響する要因は正確には不明だが、恐らく局所的高濃度の複合体とリンパ排液の減少(それによる複合体清掃の弱化)が主要因である。
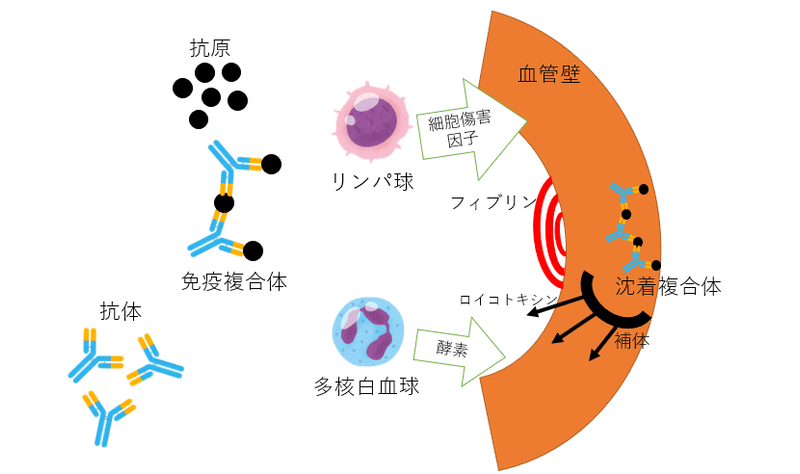
複合体沈着後の現象
抗体が抗原と結合すると、
・重鎖のFc部位が活性化し、
・非免疫的な循環リンパ球(恐らくB細胞)を遊走、或いは
・補体カスケードを活性化させる(Hobbs, 1971)。
いずれの機構も複合体の循環中は臨床的に意味をなさないが、複合体の沈着後は組織傷害を惹起する。
複合体沈着後に生じる主な現象を図3に示す。この連続的な現象の細胞側の側面をダイアグラム1に示す。
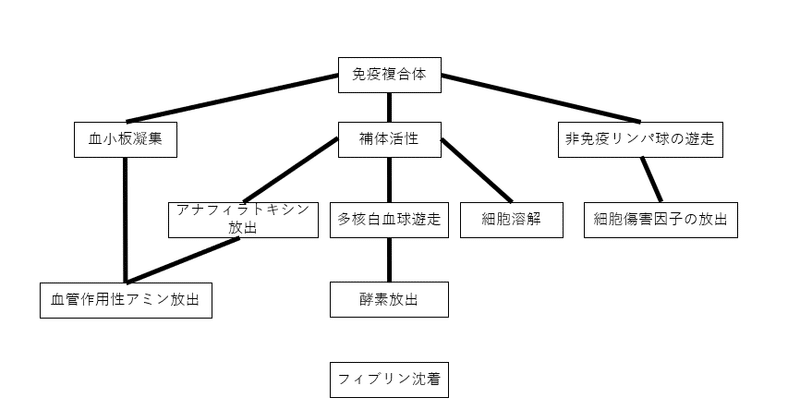
補体が活性化すると多核白血球が遊走され
補体が活性していない場合、リンパ球の遊走が起こる
補体は通常、多核白血球の浸潤に伴う沈着複合体から検出されるが、非免疫リンパ球の浸潤に伴う複合体から検出されることは稀である。
組織傷害に関して重要な現象は
ⅰ)非免疫リンパ球の遊走と細胞傷害因子の産生(Hobbs, 1971)
ⅱ)補体活性
ⅲ)多核白血球の遊走、続くタンパク溶解リソソーム酵素の放出
ⅳ)フィブリンの沈着
***これは恐らく極短期間の内に発生し、不可逆的病変を起こす
ⅴ)血小板による血管作用性アミンの放出
免疫複合体沈着に関連する組織学的特徴
上記の一連の現象は、いくつかの組織像に繋がる可能性がある(Humphrey and White,1970)。
皮膚におけるアルザス反応は、
・数時間後に大量の好中球の浸潤、
・全身浮腫、
・静脈および細動脈の局所的分節壊死、
・血小板-白血球血栓を認め、
その後
・好中球の変性と
・リンパ球、巨赤血球、好酸球の集積
を特徴とする。
急性血清病や一部の溶連菌感染後腎炎の腎臓では、内皮細胞の腫脹と増殖、茎細胞の腫脹、多核白血球の斑状出現が見られる。
また、糸球体基底膜の局所的な肥厚と透過性が散見されるが、上皮細胞は至って正常である。慢性腎炎では、基底膜の上皮側に複合体が沈着し、基底膜は塊状に肥厚し、足突起の顕著な乱れが見られる。
もう一つの経過は、実験用ウサギに極めて高い抗原性の投与を実施した場合に見られ、ここでは、壊死性動脈炎、長引く血清病による壊死性・増殖性糸球体腎炎に加えて、肉芽腫が見られる(Germuth and Pollack,1967)。肺静脈およびその周辺組織、脾臓、リンパ節(特に外套膜帯のマルピーギ濾胞)に発生し、時に肝門脈にも発生することがある。これらの肉芽腫は、上皮細胞および巨細胞の不連続な集合体であり、細網内皮細胞による巨大な不溶性複合体の除去と滞留の組織学的反映である(Germuth and Pollack,1958)。
免疫複合体の臨床的症状
免疫複合体の臨床症状は膨大な数になる。主だったものを表1に示す。
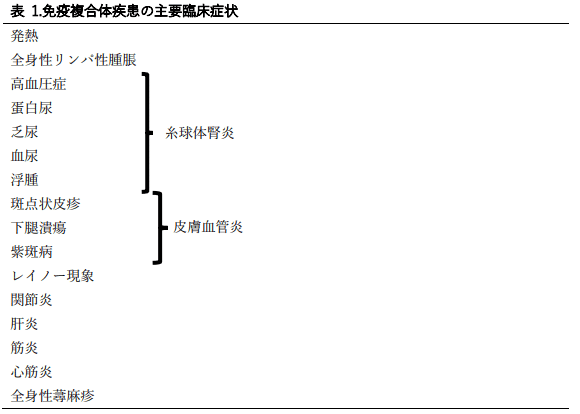
混合型クリオグロブリン血症に伴う結節性皮膚血管炎(図4)は、モノクローナル性クリオグロブリン血症に伴う、扁平で、時に潰瘍性となる皮膚病変とは区別される。表1に示した全ての特徴が常に出現するわけではなく、実際の疾患の発現は、抗原、投与量、投与経路および投与後の経過時間によって異なる。
免疫複合体の沈着に伴う疾患
免疫複合体疾患は、全身性疾患と局所性疾患に区分するのが簡便であり、これらは主に複合体のサイズに関連する。
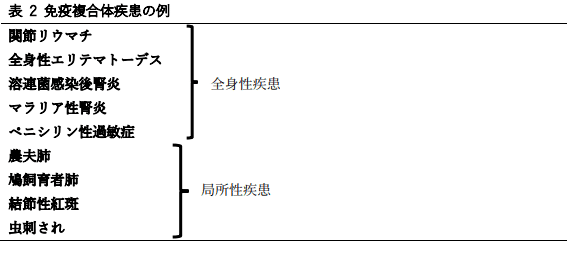
全身性疾患の例は、
・関節リウマチ(Whaley and Dick,1969)
・全身性エリテマトーデス(以下SLE) (Christian,1969)
・諸種の連鎖球菌への感染後腎炎(Markowitz and Lange,1964;Dixon、Wilson、 and Marquardt,1971)
・マラリア腎炎
・ペニシリン等、薬剤への過敏症(Copeman,1972)
そして恐らく諸種の
・ウイルス疾患
などが挙げられる。SLEはミクソウイルスの核酸への反応と、自身の核酸への交差反応であると考えられる(Gyorkey and others,1969)。
局所性疾患には
・農夫肺
※カビの生えた干草にいる好熱性放線菌に感作された患者の肺で生じるアルザス反応を特徴とする吸入性疾患
・鳩飼育者肺
※乾燥した鳥糞の吸入によるタンパク抗原への過敏症
・結節性紅斑
・虫刺され
・ウイルス疾患の合併症
※麻疹後脳炎、風疹関節炎
・細菌性疾患の合併症
※淋菌性関節炎
などが挙げられる。
表2に要約したこの一覧は、免疫複合体の沈着が観測される疾患の幅広さを示している。疾患の病因の理解が進めば、この一覧は間違いなく増えていくだろう。
免疫複合体疾患の診断
2つの主要な調査項目は、循環性複合体及び補体の血清検査と、沈着複合体の組織生検である。
1) 血清
免疫複合体は、4℃で徐々に沈殿(3~4日を要する)させるか、最新の超遠心分離技術により確認が可能である。過剰な複合体が存在する場合、7Sと19Sの間に凸が出現する(ダイアグラム2)。
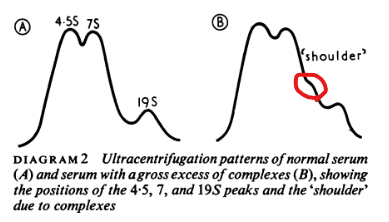
A(左):通常の血清を超遠心分離
B(右):過剰な免疫複合体のある血清の超遠心分離
4,5,7,19Sのピークの位置を表しており、
Bは免疫複合体により7~19Sの間に凸が見られる
※4S、5S、7S、19Sとは
→沈降係数(sedimentation coefficient)
遠心分離の際に溶質が沈降していく速度を示す係数。超遠心分離機の開発者テオドール・スベドベリにちなんで,Sという単位をもって示し,1Sは 1×10-13秒にあたる。同一の溶質分子でも,溶液の密度,温度,粘度などによって S値は異なり,また一般に分子量が同じならば比重の小さいもの,形状としては近似的に球形であるものよりは球に遠い形のもののほうが,S値は小さい。
↓Mit解釈
→血清を遠心分離にかけると、含有成分がそれぞれ固有の速度で沈殿する
➡血中に免疫複合体がいると、新たに沈殿する物質が現れる
血清補体検査も実用的であるかもしれない。2つの最も有用な検査はC3(β1c)濃度と補体転換産物の検出/欠損である。前者は血清病、特にSLEでは低補体血症が時に観測され、後者は補体活性の有無の指標となる可能性がある為である。共に、交差免疫電気泳動により実施される。図5は、健常者と比較してSLE患者でC3の減少があることと、補体転換産物の存在も示している。
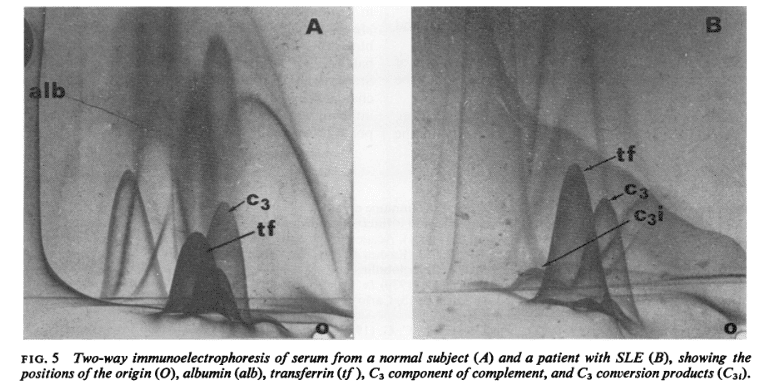
A(左):健常者の血清
B(右):SLE患者の血清
alb:アルブミン
tf:トランスフェリン
C3:補体C3成分
C3i:C3転換産物
2) 組織生検
免疫蛍光染色技術により、組織生検での抗体、補体、フィブリノーゲン、抗原の検出が可能である。全て免疫複合体疾患患者の皮膚の組織から検出される。
免疫複合体疾患の治療
現時点でこれは経験則に過ぎないが、免疫複合体疾患のプロセスの理解が進むに連れ、より合理的な戦略が可能となるだろう。
現時点で利用可能な治療法は以下の通りである。
1) ステロイド
リソソーム膜を安定させ、タンパク分解酵素の放出を阻害し、循環系の非免疫リンパ球の選択数を抑制し、また、血小板と補体機能にも影響する。
2) 抗ヒスタミン剤
諸種の血管作用性アミンの活性を阻害する
3) ヘパリン
フィブリンの沈着を阻害する。使用する場合は疾患プロセスの初期段階で使用するべきだが、これはフィブリンの沈殿が始まると失効する為である。
現時点で未使用の薬剤が将来的に使用される可能性もある。候補としては、
・貪食の阻害
・沈殿が開始したフィブリンの溶解
・補体活性の阻害
・抗体と抗原のバランスの変化(Soothill and Steward, 1971)
が挙げられる。
抗 体 - 抗 原 比は、
・免 疫 抑 制 剤 の 投 与
・抗 体 の 注 入
・(ア ジュ バ ン ト の 併 用で)追加の抗 原 投 与
で変 化 す る可能性がある。
